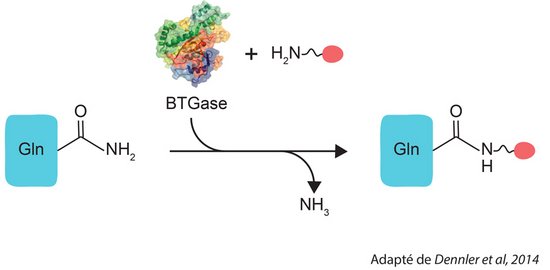
La conjugaison enzymatique utilisant une transglutaminase bactérienne (BTG) permet une conjugaison site-spécifique. La technique a été développée en collaboration avec Innate Pharma et est actuellement largement utilisée chez MImAbs pour produire les immunoconjugués (ADCs).
Le seul donneur γ-carbonylamide possible sur un anticorps pour la réaction BTG est une glutamine conservée située en position 295 du domaine constant sur la chaîne lourde. Les ADCs ainsi produits portent de manière homogène une charge par chaîne lourde (Jeger et al, Angew. Chem. Int. Ed. 2010) et présentent donc un ratio très précis de médicament/anticorps (DAR) de 2.
Des modifications dans la méthode ont permi d'élargir les possibilités qu’elle offre aujourd'hui :
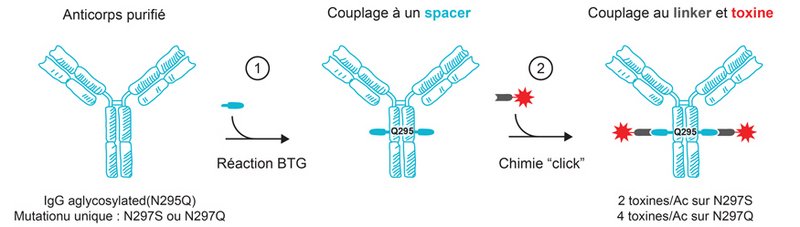
Optimisation des conditions de réaction et meilleure homogénéité. Les conditions de la réaction incluent désormais (1) une réaction enzymatique qui couple des spacers à l’anticorps par réaction BTG et (2) une réaction basée sur la chimie dite 'click' qui couple un ligand et une charge cytotoxique au spacer. Ce processus chimio-enzymatique à deux étapes offre une flexibilité d’adaptation aux besoins des chaque ADC et garantit l’obtention d’immunoconjugués hautement homogènes, tout en utilisant de plus faibles quantités de toxines, souvent coûteuses, que des méthodes alternatives (Dennler et al, Bioconjugate Chem 2014).
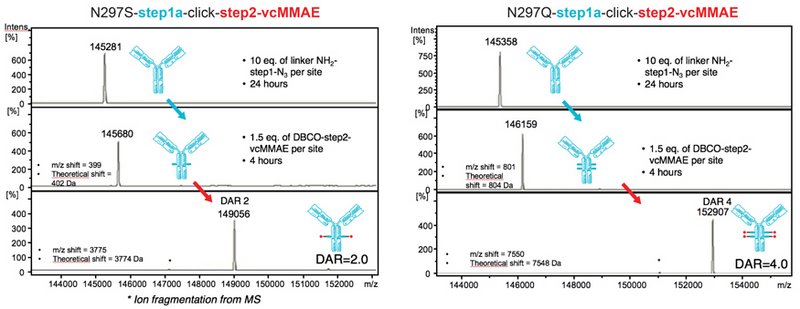
Ratio toxine/anticorps plus élevé. La mutation de l’asparagine 297 en glutamine sur la chaine lourde crée un nouveau site d’ancrage pour les charges cytotoxiques. Les ADCs résultant de ces anticorps mutants forment une population homogène ayant un DAR de 4 (Jeger et al, Angew. Chem. Int. Ed. 2010). Comme indiqué dans l’exemple ci-dessous, le DAR ainsi obtenu avec une conjugaison BTG est extrêmement précis (2 ou 4).
Profils de spectrométrie de masse à différentes étapes du processus de conjugaison BTG d’un anticorps ‘wild-type’ (gauche) ou d’un anticorps muté au niveau de la glutamine 297 (droite) pour produire des ADCs avec une DAR=2 ou DAR=4, respectivement.
Points importants :
Cette technologie peut être utilisée uniquement avec des anticorps déglycosylés ; ceux-ci peuvent être produits soit par déglycosylation chimique avant la réaction BTG, soit par modification génétique pour abolir le site de N-glycosylation sur l’anticorps.
Les deux méthodes (DR=2 et DAR=4) ont déjà été utilisées sur de multiples anticorps différents et à différentes échelles (de 1mg à 100mg).
EFFICACITE
Les ADCs ainsi produits ont une efficacité équivalente à celle d’immunoconjugués produits par des méthodes alternatives :
Brentuximab vs. un ADC équivalent produit par BTG. Test de viabilité cellulaire (CellTiter Glo® Luminescent) sur des cellules KARPAS 299 : un anti-CD30 couplé à la MMAE par réaction BTG a une efficacité très similaire au Brentuximab (Adcetris®, même anti-CD30 chimiquement couplé à la MMAE).
Au-delà des ADCs, d'autres conjugaisons par BTG
En utilisant la conjugaison chimio-enzymatique par BTG, n’importe quelle molécule avec un groupe compatible à la chimie click peut être couplée à un IgG. La méthode a donc été déclinée pour produire d’autres dérivés d’anticorps, tels que :
Anticorps bispécifiques : les formats d’anticorps bispécifiques IgG-Fab Bi-Abs et Fab x 2 sont efficaces et produits de manière courante au sein du département de biochimie de MI-mAbs. D’autres formats peuvent également être facilement produits (VHH, nanocorps, scFvs; voir Anticorps Bispecifiques)
Anticorps marqués : Toutes sortes de marqueurs ou entités chimiques peuvent être conjuguées aux anticorps, par exemple des fluorophores type Alexa Fluor®, des peptides, des oligonucléotides etc.