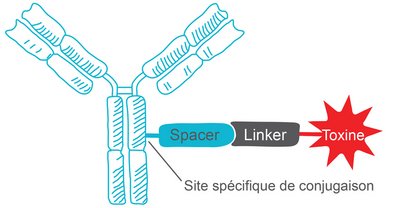
Les anticorps immuno-conjugués (ADCs) sont une nouvelle approche dans le traitement du cancer. Un ADC comprend trois composants critiques : l’anticorps lui-même, la charge cytotoxique et entre les deux, un ligand jouant un rôle important au moment de la libération de la toxine.
Architecture d'un ADC
MImAbs réalise des conjugaisons site-spécifique selon deux méthodes préférentielles :
Transglutamination. Cette méthode de couplage chimio-enzymatique utilise une transglutaminase microbienne pour créer une liaison covalente entre la chaîne lourde d’un anticorps aglycosylé et un substrat, afin d’obtenir un ratio toxine/anticorps précis de 2:1 ou 4:1.
Une description détaillée de la technologie développée en collaboration avec Innate Pharma est disponible ici.
Conjugaison sur des résidus cystéine. La conjugaison se fait par une réaction chimique maléimide-thiol qui crée une liaison thioester entre le groupe sulfhydryl d’une cystéine et le réactif à coupler. Les anticorps ne contiennent pas de cystéines disponibles et exposées, c’est pourquoi une cystéine est introduite par mutagénèse à un site connu à la surface de la structure de l’anticorps pour que la réaction puisse avoir lieu. Cette conjugaison est ainsi site-spécifique et permet d’obtenir un ratio toxine/anticorps de 2:1.
La charge cytotoxique, mais aussi le ligand, sont critiques pour la structure d’un ADC. MImAbs possède une collection grandissante de toxines et ligands disponibles pouvant être adaptés aux besoins d’un projet.
Toxines. Puisque seulement 2-3% d’un ADC injecté atteint sa cible, les charges doivent être dotées d’un effet cytotoxique puissant à l’échelle du nano au picomolaire. Il existe trois familles principales de charges cytotoxiques : celles qui perturbent les microtubules, celles qui endommagent l’ADN et celles qui endommagent l’ARN.
Linkers. Ils sont essentiels pour permettre la libération des toxines au bon moment et au bon endroit pendant le traitement.
Linkers non clivables – La libération des toxines requiert la dégradation complète de l’anticorps. Les avantages de ces ligands incluent une stabilité accrue dans le plasma et une réduction de la toxicité hors cible.
Linkers clivables – La libération des toxines est provoquée par l’environnement. Ils peuvent être soit chimiquement labiles, soit clivables par une enzyme. Les avantages de ces ligands incluent une libération plus rapide du médicament et un effet de proximitéaccru.
Les couples toxines-ligands disponibles chez MImAbs – à des fins de recherche uniquement
| Toxine | Linker |
MMAF
| Monomethyl auristatin F Perturbe l'intégrité des microtubules | Non-cleavable |
Ahx-DM1 | Maytansinoid Perturbe l'intégrité des microtubules | Non-cleavable |
vc-PAB-MMAE | Monomethyl auristatin E Perturbe l'intégrité des microtubules | Cleavable Cathepsin-mediated cleavage in lysosomes |
va-PAB-PBD | Pyrrolobenzodiazepines Endommagent l'ADN | Cleavable Cathepsin-mediated cleavage in lysosomes |
Ces formats d’ADC sont produits jusqu’a une échelle de 100mg.
Note : d’autres toxines, composants chimiques et ligands peuvent également être utilisés si nécessaire. Les méthodes de conjugaison disponibles chez MImAbs utilisent un couplage maléimide ou un couplage basé sur la chimie « click » (Azido, cyclooctène ou TCO) sur la toxine ou autre composant chimique.
Deux étapes séquentielles sont effectuées et requièrent quelques milligrammes de conjugués :
1. Développement et validation de lignées cellulaires appropriées
Des lignées cellulaires modèles sont produites par transfection avec la cible. Si disponibles, des lignées cellulaires cancéreuses exprimant naturellement la cible sont également utilisées. Dans les deux cas, l’expression de la cible est vérifiée par cytométrie de flux.
2. Analyse de cytotoxicité
CellTiter Glo® : essai de viabilité cellulaire par luminescence.
Dans l’exemple ci-dessous, l’analyse utilise un anticorps couplé à deux toxines différentes (à gauche et au centre) et un isotype contrôle (à droite).
Prolifération cellulaire en utilisant le système d’analyse en temps réel IncuCyte® ZOOM.
Dans l’exemple ci-dessous, l’analyse est réalisée à l’aide d’un ADC et d’un isotype contrôle.
Des cellules humaines d’origine cancéreuse sont greffées chez des souris immuno-déficientes (modèles de xénogreffe). S’ensuivent une bioanalyse standard de l’ADC (MTD, PK, PD), et une évaluation des variations du volume tumoral et de la survie des souris. Vingt à 100 mg d’un ADC sont nécessaires à cette étape.
Volume tumoral :
Les souris ont été traitées avec le véhicule, un isotype contrôle (IC) ou l’ADC à tester à deux doses différentes. L’ADC provoque la réduction du volume tumoral (dose 1) ou la régression de la tumeur (dose 2).
Survie :
La survie des souris est considérablement plus élevée avec le traitement ADC aux deux doses qu’avec les traitements IC et véhicule (statistiques : test Mantel-Cox).